На главную страницу
Представление и анализ структурных химических формул в компьютерных программах
Введение
© Захаров С.В.
Любая молекула или молекулярная частица (ион, радикал) может быть однозначно описана структурной химической формулой, при условии, что эта формула содержит также информацию о геометрической конфигурации атомов. Иными словами, при описания того, как молекула построена из атомов, необходимо привести следующие данные:
-
Молекулярный граф, указывающий, какие атомы с какими атомами связаны внутри молекулы, т.е. классическую структурную формулу. Обычно задаются также характеристики связей между атомами, так, как правило указывается кратность связи (ординарная, двойная, тройная и т.д.). Строго говоря, кратность связи следует из структуры молекулы, т.е., не может существовать двух молекул, в которых атомы связаны между собой одинаково, но с различной кратностью соответствующих связей. Однако понятие о кратности связей необходимо для описания фрагментов молекул, для которых однозначно установить кратность связи невозможно. Поэтому понятие кратности связи в программной модели молекулы (как и фрагментов молекул) следует сохранить.
Описание молекулы классической структурной формулой обусловлено тем, что связи в молекуле не разрушаются и не создаются (разумеется, если не происходит химическая реакция, но в этом случае наша молекула превращается в другие молекулы, и описывать придётся уже их).
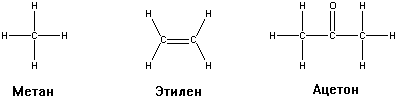
Примеры структурных формул - молекулярных графов.
-
Пространственные характеристики образуемых атомами связей. Введение этой характеристики связано с тем, что многие атомы образуют химические связи расположенными в пространстве вполне определённым образом друг относительно друга. Типичный пример - четырёхкоординированный атом углерода в органических соединениях. Образуемые им химические связи направлены в пространстве к вершинам воображаемого тетраэдра, и не могут существенно изменять величины образуемых ими между собой углов. Хотя все четыре таких связи эквивалентны между собой геометрически, но если все они оказываются связанными с разными химическими группами или атомами, то их атом углерода становится ассиметрическим центром, и возникает явление энантиомерии, или оптической изомерии. Это явление заключается в том, что атомы в обеих молекулах связаны одинаковым образом, но эти две молекулы невозможно никаким вращением совместить в пространстве, так как они относятся друг к другу, как отражения в зеркале. Такие молекулы и вещества, из них состоящие, называют оптически активными. Все физические и химические свойства, не имеющие отношения к понятиям правое/левое (температура плавления, коэффициент преломления, реакционная способность по отношению к неактивным оптически веществам и т.п.), веществ, состоящих из таких молекул, будут совпадать. Однако другие свойства (направление вращения плоскости поляризации света, химические реакции с оптически активными веществами и т.д.) будут различны. Кристаллы оптических изомеров также относятся друг к другу как отражения в зеркале (на этом основан один из способов разделения смесей таких изомеров - отбор кристаллов). Из-за вращения плоскости поляризации растворами таких веществ подобные вещества и были названы оптически активными. Растворы не имеющих оптических изомеров веществ, равно как и растворы равных смесей оптических изомеров, не вращают плоскость поляризации.
Если в молекуле имеется более одного ассиметрического центра, то, чаще всего, возникает явление диастериомерии. Диастериомеры уже различаются между собой по химическим и физическим свойствам.
-
Характеристики связей. Здесь я не имею в виду кратность, т.к. она указывается при описании молекулярного графа (пункт 1). Дело в том, что некоторые атомы в определённых состояниях образуют несколько различающихся геометрически типов связей: так, пятивалентный пятикоординированный фосфор образует две "аксиальные" и три "экваториальные" связи, которые, к тому же, существенно отличаются по длине:.
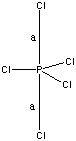
Аксиальные (помечены буквой "a") и экваториальные связи в молекуле PCl5.
Также для полноты характеристики структуры молекулы необходимо указать электрический заряд молекулярной частицы (очень небольшое по абсолютной величине целое число, для молекулы - 0).
Таким образом, можно подвести следующие итоги:
-
Для исчерпывающего описания структуры даже сложной молекулы необходимо очень небольшое количество параметров.
-
Структура молекул полностью определяет физические и химические свойства состоящих из них веществ (типа плотности, точки кипения, коэффициента преломления, растворимости, длин связей, валентных углов, спектров, способности к определённым химическим реакциям и всех прочих).
-
Более того, известны все законы природы, которые позволяют определить упомянутые практически важные свойства вещества исходя из заданной небольшим числом параметров структуры его молекул.
Для изолированной молекулы не составляет труда даже записать уравнение, полностью её описывающее (уравнение Шредингера, возможно, в его релятивистской форме или с релятивистскими поправками).
-
Тем не менее, при современном развитии математики и, особенно, вычислительной техники, производить такого рода расчёты с практически приемлимой точностью, в подавляющем большинстве случаев, оказывается невозможным (и вряд ли скоро станет возможным).
-
Таким образом, задача может быть однозначно поставлена заданием очень небольшого количества исходных данных, но практически решена в настоящее время быть не может.
-
И единственным выходом на данный момент (и на обозримое будущее) является комбинация эмпирических и теоретических подходов, с постепенным переходом от последних к первым, насколько это оказывается возможным. Насколько - тоже очень сложный, но и очень интересный, вопрос.
Таким образом, для описания класса "молекула", по видимому, разумно сначала описать её молекулярный граф - структурную формулу (пункт 1). Необходимость в описании пространственных характеристик (пункт 2) возникает для относительно небольшой доли молекул, а необходимость различать аксиальные, экваториальные и т.п. типы связей (пункт 3) - ещё реже.
1. Описание молекулы как молекулярного графа
На главную страницу

